Principe de fonctionnement de la batterie
Comment fonctionnent une horloge murale, une télécommande de télévision ou un jouet pour enfant radiocommandé ? La plupart des gens, sans hésiter, répondront « à partir de piles » et, en principe, ils auront raison. Mais il est peu probable qu'aucun d'entre eux soit en mesure de dire comment exactement la batterie portable est triplée, comment elle fonctionne et sans laquelle tout le processus de transmission du courant électrique de la batterie au consommateur final serait impossible. Comblons cette lacune ennuyeuse dans les connaissances.
Le contenu de l'article
Principe de fonctionnement de la batterie
Afin de comprendre le principe de fonctionnement d'une pile AA classique, vous devez avoir une compréhension générale de sa structure. Ainsi, toute batterie se compose de trois éléments principaux : l'anode, la cathode et l'électrolyte. De plus, ces dernières peuvent avoir pratiquement n'importe quel état d'agrégation : la cathode et l'anode placées dans une solution saline sont en principe aussi une « batterie », mais sous une forme inhabituelle pour l'homme moyen.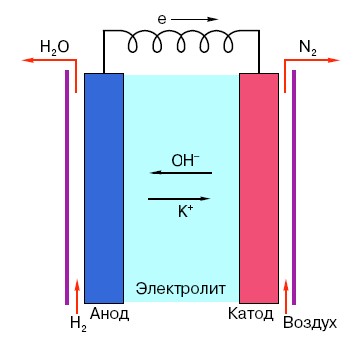
Intéressant! La « colonne voltaïque », inventée par Alessandro Volta, possédait également tous les éléments nécessaires à la production de courant électrique. Il s'agissait de plaques de zinc et de cuivre empilées les unes sur les autres, entre lesquelles un tissu imbibé d'acide était placé comme une « couche ».
L'anode de tels systèmes est la principale source d'électrons qui, comme nous le savons grâce aux cours de physique à l'école, ont une charge négative.Les particules chargées négativement sont attirées par les particules positives, et dans ce cas la surface de la cathode agit comme un « plus ».
Mais cela ne suffit pas pour qu'un courant électrique se produise, car les électrons ont également besoin d'une sorte d'« autoroute » - un milieu qui soutiendrait l'interaction de la cathode et de l'anode. C'est ici qu'apparaît « sur scène » un électrolyte - un sel, un alcali ou un acide capable de conduire le courant.
Regardons le principe de fonctionnement à l'aide d'un exemple précis : il existe une batterie de 18 volts. La tension entre les électrodes est stable jusqu'à ce qu'elle soit connectée au réseau. Dès qu'un consommateur apparaît (par exemple, une ampoule ordinaire), la tension commence à diminuer progressivement, le courant commence à circuler de l'électrode « négative » à l'électrode « positive » et une réaction chimique se produit dans l'électrolyte visant à maintenir la différence de potentiel entre les électrodes.
Référence. Plus le consommateur a besoin d'énergie, plus la réaction à l'intérieur de la batterie est intense et plus elle tombera en panne rapidement.
Comment fonctionne une batterie rechargeable, en quoi elle diffère d'une batterie ordinaire
Nous avons donc regardé les piles classiques « doigt » et « petit doigt » et nous savons que la durée de vie de la plupart d'entre elles est strictement limitée (quoi qu'en disent les fabricants célèbres). Mais qu'en est-il des soi-disant batteries - des batteries de type batterie qui peuvent non seulement consommer de l'énergie pendant le processus de réaction, mais également l'accumuler et la stocker pendant une longue période ?
Afin de comprendre le principe de fonctionnement de la batterie, il faut se tourner vers la chimie. Prenons comme exemple... Un feu de charbon de bois ordinaire.Aussi belle et fascinante que soit la flamme, tout chimiste qui l’observe sait que ce processus n’est qu’une réaction à long terme d’oxydation du carburant. La combustion du charbon interagit avec l'oxygène et à la suite de cette réaction, nous obtenons :
- gaz carbonique;
- lumière;
- chaud.
Et si les deux derniers points sont capables de réchauffer l'âme et le corps, alors nous ne pouvons en aucun cas utiliser le dioxyde de carbone, car c'est un sous-produit de la réaction, qui est en fait ses déchets. La réaction d'oxydation s'arrête lorsque les éléments de départ : l'oxygène et le charbon s'épuisent. L'arrêt de la réaction dans une batterie se produit exactement de la même manière lorsque les substances de départ sont complètement épuisées et qu'il ne reste que des « déchets ».
Dans la batterie, tout se passe un peu différemment. Le fait est que la réaction qui s'y produit appartient à la catégorie des réversibles, c'est-à-dire que, dans certaines conditions, elle peut être « inversée », ramenant toutes les substances à leur état d'origine. C'est la possibilité qu'une réaction réversible se produise dans la batterie qui permet de la charger.
Dans une batterie connectée au réseau, la réaction se déroule dans le sens opposé, et le courant passe du « plus » au « moins », et non l'inverse. En conséquence, le produit de la réaction forme les substances de départ et le propriétaire de la batterie reçoit l'énergie « récupérée » disponible dans un format portable. C'est tout!





